Los alcanos son hidrocarburos, es decir, que tienen solo átomos de carbono e hidrógeno. La fórmula general para alcanos alifáticos (de cadena lineal) es CnH2n+2, y para cicloalcanos es CnH2n. También reciben el nombre de hidrocarburos saturados.
El alcano más sencillo es el metano con un solo átomo de carbono. Otros alcanos conocidos son el etano, propano y el butano con dos, tres y cuatro átomos de carbono respectivamente. A partir de cinco carbonos, los nombres se derivan de numerales griegos: pentano, hexano, heptano...
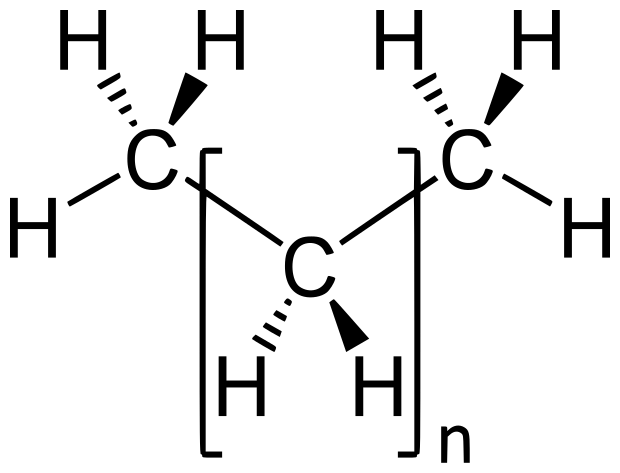 |
| Fórmula general de los alcanos |