Hidróxidos
Los hidróxidos se caracterizan por tener el grupo OH-, llamado hidróxido, de valencia -1, unido a un metal. Estos compuestos se llaman hidróxidos (o bases) por el carácter básico de sus disoluciones acuosas. Según la IUPAC, se nombran con la palabra genérica hidróxido seguida del metal correspondiente en genitivo; si el metal necesita especificar la valencia, se utiliza la notación de Stock. El grupo hidróxido se coloca siempre a la derecha por ser más electronegativo que el metal.
lunes, 3 de febrero de 2014
Óxidos
Óxidos

Un Óxido es un compuesto inorgánico que se forma al unir algún elemento químico con Oxígeno. Los óxidos se clasifican en dos grupos: Óxidos Básicos y Óxidos Ácidos.
Un Óxido es básico si el elemento químico que se junta con el Oxígeno (O) es un metal. Un Óxido es Ácido si el elemento químico que se junta con el oxígeno es un no metal.

Catión
Catión
Un catión es un ión (o sea átomo o molécula) con carga eléctrica positiva, es decir, que ha perdido electrones. Los cationes se describen con un estado de oxidación positivo.
Un catión es un ión (o sea átomo o molécula) con carga eléctrica positiva, es decir, que ha perdido electrones. Los cationes se describen con un estado de oxidación positivo.
Anión
Anión
El anión, que es un ion que dispone de carga negativa. Esto se produce como consecuencia de haber ganado determinados electrones.
Es posible distinguir entre aniones monoatómicos y aniones poliatómicos. En el primer conjunto, encontramos aniones que exhiben un estado de oxidación de tipo negativo, mientras que, en el segundo, el estado de oxidación de cada átomo puede variar, aunque el conjunto siempre está vinculado a partir de una carga general negativa.
El anión, que es un ion que dispone de carga negativa. Esto se produce como consecuencia de haber ganado determinados electrones.
Es posible distinguir entre aniones monoatómicos y aniones poliatómicos. En el primer conjunto, encontramos aniones que exhiben un estado de oxidación de tipo negativo, mientras que, en el segundo, el estado de oxidación de cada átomo puede variar, aunque el conjunto siempre está vinculado a partir de una carga general negativa.
Ión
Ión
En química, se define al ion o ión como un átomo o molécula que perdió su neutralidad eléctrica por que ha ganado o perdido electrones de su dotación, originalmente neutra, fenómeno que se conoce como ionización.
Los iones cargados negativamente, producidos por la ganancia de electrones, se conocen como aniones y los cargados positivamente, consecuencia de una pérdida de electrones, se conocen como cationes.

En química, se define al ion o ión como un átomo o molécula que perdió su neutralidad eléctrica por que ha ganado o perdido electrones de su dotación, originalmente neutra, fenómeno que se conoce como ionización.
Los iones cargados negativamente, producidos por la ganancia de electrones, se conocen como aniones y los cargados positivamente, consecuencia de una pérdida de electrones, se conocen como cationes.

Biomasa
Biomasa
Se denomina biomasa a toda la materia orgánica que se encuentra en la tierra. Como fuente de energía presenta una enorme versatilidad, permitiendo obtener mediante diferentes procedimientos tanto combustibles sólidos como líquidos o gaseosos. De origen vegetal o animal, que incluye los materiales que proceden de la transformación natural o artificial. Cualquier tipo de biomasa proviene de la reacción de la fotosíntesis vegetal, que sintetiza sustancias orgánicas a partir del CO2 del aire y de otras sustancias simples, aprovechando la energía del sol.

Se denomina biomasa a toda la materia orgánica que se encuentra en la tierra. Como fuente de energía presenta una enorme versatilidad, permitiendo obtener mediante diferentes procedimientos tanto combustibles sólidos como líquidos o gaseosos. De origen vegetal o animal, que incluye los materiales que proceden de la transformación natural o artificial. Cualquier tipo de biomasa proviene de la reacción de la fotosíntesis vegetal, que sintetiza sustancias orgánicas a partir del CO2 del aire y de otras sustancias simples, aprovechando la energía del sol.

Humus
Humus
El humus es la materia orgánica en descomposición que se encuentra en el suelo. Procede de restos vegetales y animales.
La composición química del humus varía porque depende de la acción de organismos vivos del suelo, como bacterias, protozoos, hongos y ciertos tipos de escarabajos, pero casi siempre contiene cantidades variables de proteínas y ciertos ácidos y sus derivados. El humus es una materia homogénea, amorfa, de color oscuro e inodoro.Al descomponerse en humus, los residuos vegetales se convierten en formas estables que se almacenan en el suelo y pueden ser utilizados como alimento por las plantas. La cantidad de humus afecta también a las propiedades físicas del suelo tan importantes como su estructura, color, textura y capacidad de retención de la humedad.

El humus es la materia orgánica en descomposición que se encuentra en el suelo. Procede de restos vegetales y animales.
La composición química del humus varía porque depende de la acción de organismos vivos del suelo, como bacterias, protozoos, hongos y ciertos tipos de escarabajos, pero casi siempre contiene cantidades variables de proteínas y ciertos ácidos y sus derivados. El humus es una materia homogénea, amorfa, de color oscuro e inodoro.Al descomponerse en humus, los residuos vegetales se convierten en formas estables que se almacenan en el suelo y pueden ser utilizados como alimento por las plantas. La cantidad de humus afecta también a las propiedades físicas del suelo tan importantes como su estructura, color, textura y capacidad de retención de la humedad.

Mineral
Mineral
Los minerales son los bloques constructores de las rocas. Son sólidos y, como toda materia, están hechos de átomos de elementos. Existen muchos tipos diferentes de minerales, y cada tipo está hecho de un grupo particular de átomos . Los átomos se encuentran unidos, y se alinean de una manera especial llamada enrejado de cristales, o red de átomos. El enrejado de átomos es lo que le da al mineral su formal de cristal.
Los minerales son los bloques constructores de las rocas. Son sólidos y, como toda materia, están hechos de átomos de elementos. Existen muchos tipos diferentes de minerales, y cada tipo está hecho de un grupo particular de átomos . Los átomos se encuentran unidos, y se alinean de una manera especial llamada enrejado de cristales, o red de átomos. El enrejado de átomos es lo que le da al mineral su formal de cristal.
 |
| Mineral de Diamante |
Intemperismo
Intemperismo
Se llama INTEMPERISMO o METEORIZACION a la acción combinada de procesos (climáticos, biológicos, etc) mediante los cuales la roca es descompuesta y desintegrada por la exposición continua a los agente atmosféricos, transformando a las rocas masivas y duras en un manto residual finamente fragmentado.

Recurso
Recurso
Un recurso es una fuente o suministro del cual se produce un beneficio.Normalmente, los recursos son material u otros activos que son transformados para producir beneficio y en el proceso pueden ser consumidos o no estar más disponibles. Desde una perspectiva humana, un recurso natural es cualquier elemento obtenido del medio ambiente para satisfacer las necesidades y los deseos humanos. Desde un punto de vista biológico más amplio, un recurso satisface las necesidades de un organismo vivo.
Un recurso es una fuente o suministro del cual se produce un beneficio.Normalmente, los recursos son material u otros activos que son transformados para producir beneficio y en el proceso pueden ser consumidos o no estar más disponibles. Desde una perspectiva humana, un recurso natural es cualquier elemento obtenido del medio ambiente para satisfacer las necesidades y los deseos humanos. Desde un punto de vista biológico más amplio, un recurso satisface las necesidades de un organismo vivo.
Un recurso natural es un bien o servicio proporcionado por la naturaleza sin alteraciones por parte del ser humano, los recursos naturales son valiosos para las sociedades humanas por contribuir a su bienestar y a su desarrollo de manera directa (materias primas, minerales, alimentos) o indirecta (servicios ecológicos).
 |
| Recursos naturales |
Reacción química
Reacción química
La reacción química es aquel proceso químico en el cual dos sustancias o más, denominados reactivos, por la acción de un factor energético, se convierten en otras sustancias designadas como productos. Mientras tanto, las sustancias pueden ser elementos químicos (materia constituida por átomos de la misma clase) o compuestos químicos (sustancia que resulta de la unión de dos o más elementos de la tabla periódica).
El ejemplo más corriente de una reacción química es la formación de óxido de hierro, que resulta de la reacción del oxígeno del aire con el hierro.
La reacción química es aquel proceso químico en el cual dos sustancias o más, denominados reactivos, por la acción de un factor energético, se convierten en otras sustancias designadas como productos. Mientras tanto, las sustancias pueden ser elementos químicos (materia constituida por átomos de la misma clase) o compuestos químicos (sustancia que resulta de la unión de dos o más elementos de la tabla periódica).
El ejemplo más corriente de una reacción química es la formación de óxido de hierro, que resulta de la reacción del oxígeno del aire con el hierro.
 |
| Ejemplo de oxidación. |
Enlace químico
Enlace químico
Enlace significa unión, un enlace químico es la unión de dos o más átomos con un solo fin, alcanzar la estabilidad.Tratar de parecerse al gas noble más cercano. Para la mayoría de los elementos se trata de completar ocho electrones en su último nivel.
En la mayoría de los átomos con excepción de los gases nobles (muy estables, con su
última capa o nivel de energía completo con sus ocho electrones), las fuerzas atractivas
son superiores a las repulsivas y los átomos se acercan formando un enlace.
Así, podemos considerar al enlace químico como la fuerza que mantiene unidos a dos o
más átomos dentro de una molécula.
Enlace significa unión, un enlace químico es la unión de dos o más átomos con un solo fin, alcanzar la estabilidad.Tratar de parecerse al gas noble más cercano. Para la mayoría de los elementos se trata de completar ocho electrones en su último nivel.
En la mayoría de los átomos con excepción de los gases nobles (muy estables, con su
última capa o nivel de energía completo con sus ocho electrones), las fuerzas atractivas
son superiores a las repulsivas y los átomos se acercan formando un enlace.
Así, podemos considerar al enlace químico como la fuerza que mantiene unidos a dos o
más átomos dentro de una molécula.
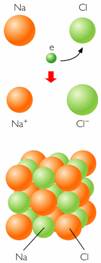 |
| La ilustración describe cristales de Cloruro de Sodio (enlace químico iónico) |
Átomo
Átomo
El átomo es la unidad más pequeña de un elemento químico que mantiene su identidad o sus propiedades y que no es posible dividir mediante procesos químicos.
La teoría aceptada hoy es que el átomo se compone de un núcleo de carga positiva formado por protones y neutrones, en conjunto conocidos como nucleones, alrededor del cual se encuentra una nube de electrones de carga negativa.
La cantidad de protones contenidas en el núcleo del átomo se conoce como número atómico, el cual se representa por la letra Z y se escribe en la parte inferior izquierda del símbolo químico. Es el que distingue a un elemento químico de otro. La cantidad total de nucleones que contiene un átomo se conoce como número másico, representado por la letra A y escrito en la parte superior izquierda del símbolo químico.
Existen también átomos que tienen el mismo número atómico, pero diferente número másico, los cuales se conocen como isótopos.
El átomo es la unidad más pequeña de un elemento químico que mantiene su identidad o sus propiedades y que no es posible dividir mediante procesos químicos.
La teoría aceptada hoy es que el átomo se compone de un núcleo de carga positiva formado por protones y neutrones, en conjunto conocidos como nucleones, alrededor del cual se encuentra una nube de electrones de carga negativa.
La cantidad de protones contenidas en el núcleo del átomo se conoce como número atómico, el cual se representa por la letra Z y se escribe en la parte inferior izquierda del símbolo químico. Es el que distingue a un elemento químico de otro. La cantidad total de nucleones que contiene un átomo se conoce como número másico, representado por la letra A y escrito en la parte superior izquierda del símbolo químico.
Existen también átomos que tienen el mismo número atómico, pero diferente número másico, los cuales se conocen como isótopos.
 |
| Representación de un átomo de Helio. |
Elemento
Elemento
Se define como elemento químico a una sustancia homogénea que no puede dividirse en sustancias más simples.
Cada elemento se compone de un solo tipo de átomo. Un mismo elemento puede presentarse en diversas formas en la naturaleza, y se refiere precisamente a que pueda encontrársela en forma gaseosa, líquida o sólida.
Elementos químicos son por ejemplo: el hidrógeno, el helio, el oxígeno, el hierro, el uranio.

Se define como elemento químico a una sustancia homogénea que no puede dividirse en sustancias más simples.
Cada elemento se compone de un solo tipo de átomo. Un mismo elemento puede presentarse en diversas formas en la naturaleza, y se refiere precisamente a que pueda encontrársela en forma gaseosa, líquida o sólida.
Elementos químicos son por ejemplo: el hidrógeno, el helio, el oxígeno, el hierro, el uranio.

Compuesto
Compuesto
Un compuesto es una
sustancia pura que contiene más de un elemento.
Los compuestos poseen una composición fija. Es decir, un
compuesto dado siempre contiene los mismos elementos con los mismos porcentajes
en masa.
Una característica esencial es que tiene una fórmula química Por ejemplo, el agua es un compuesto formado por hidrógeno y oxígeno en la razón de 2 a 1 (en número de átomos):
 |
Suscribirse a:
Entradas (Atom)