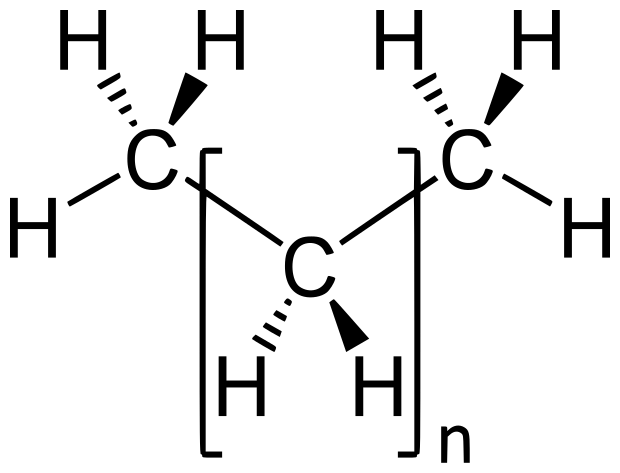
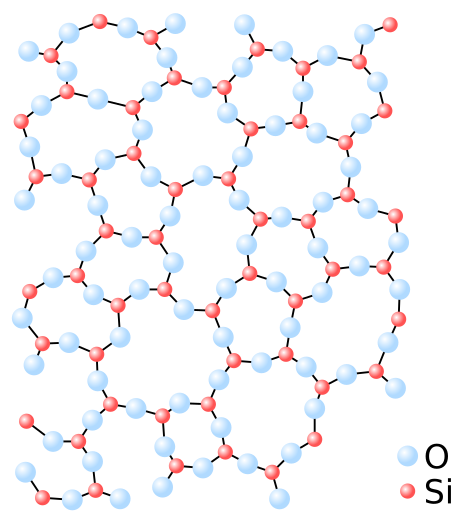
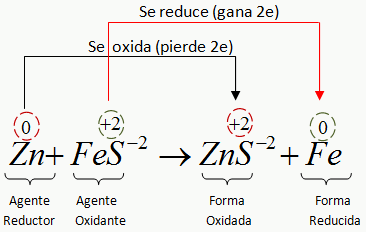
FÓRMULA: C6H6
GENERALIDADES:
El benceno es un líquido incoloro de olor característico que fue descubierto en 1825 por Faraday. Es muy inflamable, mas ligero que el agua e insoluble en ella. Sus vapores son mas densos que el aire. Es una sustancia tóxica que puede generar problemas muy graves a la salud. Se sabe que exposiciones constantes o prolongadas a este compuesto, pueden generar daños severos
a los componentes de la sangre e, incluso, leucemia. El benceno es una materia prima muy versátil. Puede utilizarse en una gran variedad de
reacciones para generar intermediarios como anhidrido maleico (para obtener poliésteres); ciclohexano y a partir de él, ácido adípico (para la elaboración nylon-66 y otras poliamidas); anilina, la cual es muy utilizada en la fabricación de colorantes; derivados clorados utilizados en la industria de pesticidas;estireno, cumeno y otros intermediarios para la elaboración de detergentes, explosivos y fármacos, entre otros.
Es buen disolvente de lacas, barnices, ceras, resinas, plásticos, hules y aceites. Por último, también es utilizado como aditivo de la gasolina. Sin embargo, debido a su gran toxicidad, en la actualidad, solo se utiliza cuando no existe un sustituto adecuado. El tolueno es uno de los disolventes que pueden utilizarse como alternativa. El benceno se obtiene del petróleo a través de procesos como: reformación catálitica, desalquilación , dehidrogenación y ciclización y aromatización de hidrocarburos parafínicos. El producto comercial puede contener tolueno, xilenos, disulfuro de carbono, tiofeno, piridina, acetonitrilo y picolinas como impurezas.















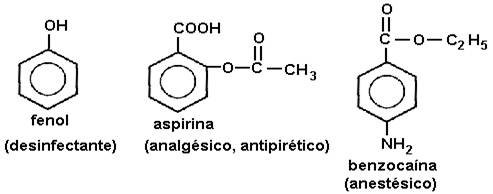
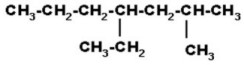
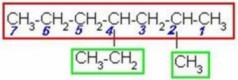
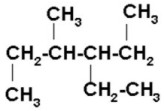
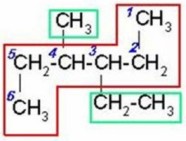
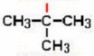

 CH etino(acetileno) CH3–C
CH etino(acetileno) CH3–C